Àcid carboxílic

Els àcids carboxílics constitueixen un grup de composts que es caracteritza pel fet que posseeixen un grup funcional anomenat grup carboxil o grup carboxi (–COOH); es produeix quan coincideixen sobre el mateix carboni un grup hidroxil (-OH) i carbonil (C=O). Es pot representar com COOH o CO₂H. Exemples importants inclouen els aminoàcids i els àcids grassos. La desprotonació d'un àcid carboxílic dóna un anió carboxilat.
Característiques i propietats
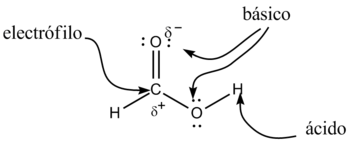
Els derivats dels àcids carboxílics tenen com a fórmula general R-COOH. Té propietats àcides; els dos àtoms d'oxigen són electronegatius i tendeixen a atraure els electrons de l'àtom d'hidrogen del grup hidroxil amb el qual es debilita l'enllaç i és més fàcil que se cedeixi el corresponent protó, H+, quedant el neutró de l'àcid, R-COO-. A més, en aquest anió, la càrrega negativa es distribueix (es deslocalitza) simètricament entre els dos àtoms d'oxigen, de forma que els enllaços carboni-oxigen adquireixen un caràcter d'enllaç parcialment doble.
Generalment, els àcids carboxílics són àcids dèbils, amb només un 1% de les seves molècules dissociades per a donar els corresponents ions, a temperatura ambient i en dissolució aquosa. Però si són més àcids que altres, en els que no es produeix aquesta deslocalització electrònica, com per exemple els alcohols. L'ió resultant, R-COO-, s'anomena amb el sufix "-at". Per exemple, l'anió procedent de l'àcid acètic s'anomena ió acetat. Al grup COO- se l'anomena carboxilat.
A continuació s'analitzarà el comportament àcid-base de diversos àcids carboxílics[1]
| Àcid | pKA | Observacions |
|---|---|---|
| Àcid carbònic | pKA1 = 6.35 pKA2 = 10.33 | Àcid dipròtic inestable dèbil ja que la seva constant d'ionització és molt petita, Ka : 0,000 000 45.[2] L'àcid carbònic pot atacar molts dels minerals que comunament formen les roques calcàries o margoses, descomponent-los per exemple a bicarbonat de calci.[3] És el producte de la reacció d'aigua i òxid de carboni (IV) i existeix en equilibri amb aquest últim, per exemple, a l'aigua gasificada o la sang. No és possible obtenir àcid carbònic pur ja que la presència d'una sola molècula d'aigua catalitzaria la seva descomposició immediata en òxid de carboni (IV) i aigua. Tot i això, es calcula que en absència absoluta d'aigua seria estable. En dissolució, l'àcid carbònic pot perdre un o dos protons. Retirant el primer protó forma l'anió bicarbonat; retirant el segon protó forma l'anió carbonat.
Els anions carbonat i bicarbonat són bases més fortes que els anions format i carboxilat. |
| Àcid fòrmic | pKA = 3.75 | El pKa de l'àcid fòrmic és més baix que per a qualsevol àcid carboxílic convencional. Per tant, s'infereix que l'àcid fòrmic és un àcid orgànic relativament més fort que el seu equivalent inorgànic, l'àcid carbònic. Això és perquè l'hidrogen no contribueix significativament a l'efecte inductiu positiu com altres àcids, mentre que quan l'àcid carbònic es desprotona, entra en ressonància i incrementa la simetria de l'anió. |
| Àcid trifluoroacètic | pKA = 0.23 | Únic cas d'un àcid carboxílic amb el carboxil enllaçat directament a un trifluorometil. Es tracta d'un àcid carboxílic fort degut a la influència de l'efecte inductiu negatiu intens que proporcionen els tres àtoms de fluor. L'àcid trifluoroacètic és gairebé 100.000 vegades més àcid que l'àcid acètic. L'àcid tricloroacètic té un pKA = 0.66, el qual segueix sent significativament alt per a un àcid carboxílic. |
| Àcid acètic | pKA = 4.76 | L'àcid acètic és l'únic àcid carboxílic on el carboxil va unit a un carboni primari. Això resta força l'efecte inductiu positiu. Podria considerar-se aquest pKa com a referència per a la resta dels àcids carboxílics. |
| Sèrie homòloga d'àcids grassos monocarboxílics lineals saturats C3 - C16 | pKAC3 = 4.88 pKAC16 = 4.75 | A mesura que incrementa la longitud de la cadena, la solubilitat en aigua disminueix significativament i s'observa el comportament típic de saponificació. Els valors mitjana de pKA per a un àcid gras monocarboxílic lineal saturat fluctuen entre 4.7 i 4.9. |
| Àcid oxàlic | pKA1 = 1.25 pKA2 = 4.14 | L'àcid oxàlic és l'únic cas en què R per a un àcid carboxílic és igual a un carboxil R = -COOH. La conseqüència d'aquest enllaç entre ambdós carboxils és la concentració de la densitat electrònica de manera simètrica cap a ambdós carbonis. L'efecte inductiu negatiu que exerceixen ambdós carboxils és fort, prou per permetre la pèrdua eficient d'un protó àcid. El primer pKA és molt més baix que per a qualsevol àcid carboxílic convencional, per això és un àcid més fort que l'àcid fòrmic, l'àcid acètic i els àcids carboxílics convencionals. |
| Àcid malònic | pKA1 = 2.83 pKA2 = 5.69 | L'àcid malònic és el més senzill dels àcids alquilendicarboxílics. Aquests sistemes 1,3-dicarbonílics es caracteritzen perquè els seus èsters són àcids febles en el carboni 2 (pKA = 14). L'efecte inductiu de tots dos carboxils a un carboni de distància queda evidenciat en un valor de pKA1 menor que el d'un àcid carboxílic convencional, mentre que el seu pKA2 és més gran que el d'un àcid carboxílic convencional a causa de l'efecte significatiu de repulsió electroestàtica i la rotació lliure dels dos carboxils. |
| Sèrie homòloga d'àcids grassos dicarboxílics lineals saturats C3 - C16 | pKA1C4 = 4.2 pKA1C10 = 4.55
| A mesura que incrementa la longitud de la cadena, la solubilitat en aigua disminueix significativament i s'observa el comportament típic de saponificació. No obstant això, els àcids dicarboxílics presenten ambdós extrems carregats elèctricament i això els fa termodinàmicament més solvatables que els seus anàlegs monocarboxílics. El segon pKA és lleugerament més alt pel fet que quan se sostreu el primer protó, la molècula presenta una càrrega formal negativa que incrementa la repulsió electroestàtica amb la base. Els valors mitjana de pKA1 per a un àcid gras lineal saturat dicarboxílic són lleugerament menors que un monocarboxílic insaturat, els quals fluctuen entre 4.2 i 4.55 entre C4 i C10. |
| Àcid pivàlic | pKA = 5.03 | És el cas més senzill d'un àcid carboxílic unit a un carboni quaternari. L'efecte inductiu positiu i l'impediment estèric redueixen l'acidesa respecte a l'àcid isovalèric (pKA = 4.77) i valèric (pKA = 4.82) |
| Àcid acrílic | pKA = 4.25 | Primer àcid de la sèrie homòloga dels àcids monocarboxílics α,β-insaturats. És lleugerament més àcid que l'àcid propiònic. |
| Àcid propargílic | pKA = 1.89 | Primer àcid de la sèrie homòloga dels àcids α,β-acetilencarboxílics. És significativament més àcid que l'àcid propiònic. La densitat electrònica amb geometria cilíndrica del sistema acetilènic sostreu densitat electrònica en què es forma un mesòmer al·lènic de geometria lineal que permet la sostracció eficient del protó àcid. |
Àcids butenodioics:
| pKA1cis = 1.90 pKA1trans = 3.03
| Ambdós casos són l'únic exemple d'un àcid dicarboxílic α,β-insaturat on ambdós carboxils comparteixen la insaturació. Tots dos són més àcids que un àcid carboxílic convencional pel fet que la distància entre ambdós carboxils i la insaturació disminueix significativament la densitat electrònica en ambdós carbonis carboxílics, però no tan dràsticament com en l'àcid oxàlic. L'àcid cis és més àcid pel fet que ambdós carboxils interactuen entre si. Quan es desprotona el primer, l'anió carboxilat 'cis' quelata fortament l'altre protó àcid, per això és menys àcid fins i tot que un àcid carboxílic convencional. En el cas de l'àcid trans, els protons àcids estan oposats. |
| Àcid acetilendicarboxílic | pKA1 = 1.73 pKA2 = 4.40 | És l'únic cas d'un àcid dicarboxilacetilènic. És significativament més àcid que l'àcid succínic i els àcids butenodioics. La densitat electrònica amb geometria cilíndrica del sistema acetilènic sostreu densitat electrònica en què es forma un mesòmer al·lènic de geometria lineal que permet la sostracció eficient del protó àcid. L'altre carboxil exerceix un efecte tant inductiu com mesomèric negatius. |
| Àcid benzoic | pKA = 4.2 | Cas més senzill i significatiu d'un àcid benzenocarboxílic. L'acidesa és lleugerament menor a la d'un àcid carboxílic saturat. Els àcids carboxílics desactiven els anells aromàtics i orienten a meta. |
| Àcid salicílic | pKACOOH = 2.97 | L'hidroxil aporta un parell electrònic que estabilitza per ressonància l'anió carboxilat format i per pont d'hidrogen i dipol permanent, els quals interactuen fortament i quelaten l'hidrogen fenòlic. |
| Àcid p-hidroxibenzoic | pKACOOH = 4.54 | Tot i que l'hidroxil aporta el parell electrònic, la dispersió de la càrrega és més eficient i, per tant, no influeix significativament en l'acidesa del carboxil. |
| Àcid picolínic (Àcid 2-piridinocarboxílic) | pKACOOH = 1.07[4] | En la ressonància de la piridina, el nitrogen presenta un efecte mesomèric negatiu i això explica la baixa de densitat electrònica al carboxil. |
| Àcid nicotínic (Àcid 3-piridinocarboxílic) | pKACOOH = 2.0 | En la ressonància de la piridina, el nitrogen presenta un efecte inductiu negatiu i això explica la baixa de densitat electrònica al carboxil. |
| Àcid isonicotínic (Àcid 4-piridinocarboxílic) | pKACOOH = 4.96 | En la ressonància de la piridina, el carboxil es troba en la posició més oposada possible i, en aquest cas, la dispersió de la càrrega és més eficient i, per tant, no influeix significativament en l'acidesa del carboxil. |
Propietats físiques
Els àcids de massa molar baixa (fins a deu àtoms de carboni) són líquids incolors, d'olor molt desagradable. L'olor del vinagre es deu a l'àcid acètic; el de la mantega rància a l'àcid butíric. L'àcid caproic es troba en el cabell i secrecions del bestiar caprí. Els àcids C5 a C10 posseeixen olors a “cabra”. La resta sòlids cerosos e inodors a temperatura ambient. Els seus punts de fusió i ebullició creixen en augmentar la massa molar.
Els àcids inferiors són solubles en aigua; la seva solubilitat decreix a partir de l'àcid butíric amb l'augment del caràcter hidrocarbonat de la molècula. Tots els àcids són solubles en solvents orgànics.
Síntesi
Rutes industrials
Les rutes industrials als àcids carboxílics difereixen generalment de les utilitzades a petita escala perquè requereixen equipament especialitzat.
- Oxidació d'aldehids amb aire, utilitzant catalitzadors de cobalt i magnesi. Els aldehids necessaris són obtinguts fàcilment a partir d'alquens per hidroformilació.
- Oxidació d'hidrocarburs utilitzant aire. Per als alcans més simples, el mètode no és selectiu. Els compostos al·lílics i benzílics pateixen oxidacions més selectives. Els grups alquil en un anell benzenic s'oxiden a l'àcid carboxílic, sense importar la longitud de la cadena. La formació d'àcid benzoic a partir del tolué, d'àcid tereftàtalic a partir del p-xilé, i d'àcid ftàlic a partir de o-xilè, són algunes conversions il·lustratives a gran escala. L'àcid acrílic és generat a partir del propè.[5]
- Deshidrogenació d'alcohols, catalitzada per bases.
- La carbonilació és el mètode més versàtil quan va acompanyat a l'addició d'aigua. Aquest mètode és efectiu per alquens que generen carbocations secundaris i terciaris, per exemple, d'isobutilè a àcid pivàlic. En la reacció de Koch, l'addició d'aigua i monòxid de carboni a alquens està catalitzat per àcids forts. L'àcid acètic i l'àcid fòrmic són produïts per la carbonilació del metanol, portada a terme amb iode i alcòxid, els quals actuen com a promotors, i freqüentment amb altes pressions de monòxid de carboni, generalment involucrant diversos passos hidrolitics addicionals, en els procés Monsanto i procés Cativa. Les hidrocarboxilacions involucren l'addició simultània d'aigua y CO. Aquestes reaccions són anomenades algunes vegades com “Química de Reppe”:
- HCCH + CO + H₂O → CH₂=CHCO₂H
- Alguns àcids carboxílics de cadena llarga són obtinguts per la hidròlisi dels triglicèrids obtinguts d'olis i grasses de plantes i animals. Aquests mètodes estan relacionats a l'elaboració de sabó.
Mètodes de laboratori
Els mètodes de preparació per a reaccions a petita escala amb fins d'investigació, instrucció, o producció de petites quantitats de químics, solen utilitzar reactius cars.
- L'oxidació d'alcohols primaris amb agents oxidants forts com el dicromat de potassi, el reactiu de Jones, el permanganat de potassi o el clorit de sodi. El mètode és adequat a les condicions de laboratori, comparat amb l'ús industrial de l'aire, però aquest últim és més ecològic, ja que condueix a menys subproductos inorgànics, com òxids de crom o magnesi.
- Ruptura oxidativa d'olefines, per ozonòlisi, permanganat de potassi o dicromat de potassi.
- Els àcids carboxílics també poden obtenir-se per la hidròlisi dels nitrils, èsters, o amides, generalment amb catàlisi àcida o bàsica.
- Carbonilació d'un reactiu d'organoliti o Grignard:
- RLi + CO₂ RCO₂Li
- RCO₂Li + HCl RCO₂H + LiCl
- Halogenació de metilcetones, seguida per hidròlisi en la reacció de l'haloform.
- La reacció de Kolbe-Schmitt, que proveeix una ruta de síntesi a l'àcid salicílic, precursor de l'aspirina.
Reaccions menys comuns
Moltes reaccions condueixen a àcids carboxílics, però són utilitzades només en casos molt específics, o principalment són d'interès acadèmic:
- Desproporció d'un aldehid en la reacció de Cannizzaro.
- Recomposició de dicetones, en la recomposició de l'àcid benzílic, involucrant la generació d'àcids benzoics en la reacció de von Richter, a partir de nitrobenzens, i en la reacció de Kolbe-Schmitt, a partir de fenols.
Reaccions
Els àcids carboxílics reaccionen amb bases per a formar sals. En aquestes sals l'hidrogen del grup OH es substitueix amb l'ió d'un metall, per exemple Na+. D'aquesta manera, l'àcid acètic reacciona amb hidrogencarbonat de sodi per a donar acetat de sodi, diòxid de carboni i aigua.
- CH₃COOH + NaHCO₃ → CH₃COONa + CO₂ + H₂O
Els grups carboxils reaccionen amb els grups amino per a formar amides. En el cas d'aminoàcids que reaccionen amb altres aminoàcids per donar proteïnes, a l'enllaç de tipus amida que es forma i s'anomena enllaç peptídic. Igualment, els àcids carboxílics poden reaccionar amb alcohols per a formar èsters, o bé amb halogenurs per a formar halogenurs d'àcid, o entre si per a formar anhídrids. Els èsters, anhídrids, halogenurs d'àcid i amides s'anomenen derivats d'àcid.
Nomenclatura
Els noms dels àcids carboxílics es designen segons la font natural de la qual inicialment es van aïllar. Es van classificar així:
| Estructura | Nom IUPAC | Nom comú | Font natural |
|---|---|---|---|
| HCOOH | Àcid metanoic | Àcid fòrmic | Destil·lació destructiva de formigues (formica en llatí) |
| CH₃COOH | Àcid etanoic | Àcid acètic | Fermentació del vi |
| CH₃CH₂COOH | Àcid propanoic | Àcid propiònic | Fermentació de làctics (pion en grec) |
| CH₃CH₂CH₂COOH | Àcid butanoic | Àcid butíric | Mantega (butyrum, en llatí) |
| CH₃(CH₂)₃COOH | Àcid pentanoic | Àcid valèric | Arrel de la Valeriana officinalis |
| CH₃(CH₂)₄COOH | Àcid hexanoic | Àcid caproic | Greix de cabra |
En el sistema IUPAC els noms dels àcids carboxílics es formen afegir “oic”, i anteposant la paraula àcid.
L'esquelet dels àcids alcanoics s'enumera assignant el Nº 1 al carboni carboxílic i continuant per la cadena més llarga que inclogui el grup COOH.
Exemples d'àcids carboxílics
- HCOOH àcid fòrmic (es troba en insectes, es refereix a les formigues)
- CH₃COOH àcid acètic o etanoic (es troba al vinagre)
- HOOC-COOH àcid etanodioic, també anomenat àcid oxàlic,
- CH₃CH₂COOH àcid propanoic
- C₆H₅COOH àcid benzoic (el benzoat de sodi, la sal de sodi de l'àcid benzoic s'utilitza com a conservant)
- Àcid làctic
- Tots els aminoàcids contenen un grup carboxil i un grup amino. Quan reacciona el grup carboxil d'un aminoàcid amb el grup amino d'un altre es forma un enllaç amida anomenat enllaç peptídic. Les proteïnes són polímers d'aminoàcids i tenen en un extrem un grup carboxil terminal.
- Tots els àcids grassos són àcids carboxílics. Per exemple, l'àcid palmític, àcid pelargònic, esteàric, oleic, linoleic, etcètera. Aquests àcids amb la glicerina formen èsters anomenats triglicèrids.
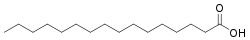
Àcid palmític o àcid hexadecanoic, es representa amb la fórmula CH₃(CH₂)14COOH
- Les sals d'àcids carboxílics de cadena llarga s'utilitzen com a tensoactius. Per exemple, l'estearat de sodi (octadecanoat de sodi), de fórmula CH₃(CH₂)16COO-Na+
- Cianoacrilat
Referències

- ↑ Brown, H.C. et al., in Braude, E.A. and F.C. Nachod. Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- ↑ Pasto, Daniel J. Determinación de estructuras orgánicas. Reverte.
- ↑ «Ácido Carbónico: Oxácido indispensable para nuestra salud.».
- ↑ https://labs.chem.ucsb.edu/zhang/liming/pdf/pKas_of_Organic_Acids_and_Bases.pdf
- ↑ Wilhelm Riemenschneider “Carboxylic Acids, Aliphatic” in Ullmann's Encyclopedia of Industrial Chemistry, 2002, Wiley-VCH, Weinheim. doi: 10.1002/14356007.a05_235
