Aromatasa
 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Identificadors | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Àlies | CYP19A1 (HUGO), ARO, ARO1, CPV1, CYAR, CYP19, CYPXIX, P-450AROM, cytochrome P450 family 19 subfamily A member 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| IDs externes | OMIM: 107910 MGI: 88587 HomoloGene: 30955 GeneCards: CYP19A1 OMA: CYP19A1 - orthologs | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
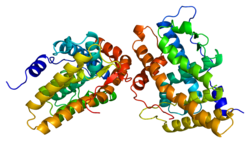
 Estructura cristal·loide del citocrom P450 aromatasa humà (N-terminal = blau, C-terminal = vermell) en el complex amb el cofactor de la protoporfirina IX (a dalt) i el substrat androstendiona (a baix) representat mitjançant el codi de colors(carboni = blanc, oxigen = vermell, nitrogen = blau i ferro = taronja)[5] | |||||||||||||
| |||||||||||||
| Identificadors | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Símbols | CYP19A1 ; ARO; ARO1; CPV1; CYAR; CYP19; MGC104309; P-450AROM | ||||||||||||
| Identif. externs | OMIM: 107910 MGI: 88587 HomoloGene: 30955 GeneCards: CYP19A1 Gene | ||||||||||||
| Número EC | 1.14.14.1 | ||||||||||||
| |||||||||||||
| Patró d'expressió d'ARN | |||||||||||||
 | |||||||||||||
| More reference expression data | |||||||||||||
| Ortòlegs | |||||||||||||
| Espècies | Humans | Ratolins | |||||||||||
| Entrez | 1588 | 13075 | |||||||||||
| Ensembl | ENSG00000137869 | ENSMUSG00000032274 | |||||||||||
| UniProt | P11511 | Q3ZAT3 | |||||||||||
| RefSeq (ARNm) | NM_000103 | NM_007810 | |||||||||||
| RefSeq (proteïna) | NP_000094 | NP_031836 | |||||||||||
| Localitz. (UCSC) | Chr 15: 49.29 – 49.4 Mb | Chr 9: 53.96 – 53.99 Mb | |||||||||||
| Cerca al PubMed | [1] | [2] | |||||||||||
L'aromatasa és un enzim responsable d'un pas clau en la biosíntesi d'estrògens.[6] Com que els estrògens també promouen certs tipus de càncer i altres malalties, els inhibidors de l'aromatasa s'utilitzen amb freqüència per al tractament d'aquestes malalties. Els esteroides es componen de quatre anells fusionats. De l'aromatasa transforma l'anell dels esteroides a un estat aromàtic (d'aquí el nom) a través de l'oxidació i posterior eliminació d'un grup metil. L'aromatasa és un membre de la superfamília del citocrom P450 (CE 1.14.14.1), la funció és aromatitzar els andrògens, produint estrògens. Com a tal, és un factor important en el desenvolupament sexual. L'aromatasa converteix la testosterona en estradiol.
Funció
És un enzim condensant que destaca per l'actuació sobre substrats als quals cicla i configura la formació d'anells aromàtics. És el complex enzimàtic encarregat de la formació d'estrona des de l'androstendiona en l'ovari.
L'activitat de l'aromatasa té lloc en el cicle del colesterol i dels esteroides (ruta 17). La reacció que té lloc és: Precursor: testosterona – Enzim: aromatasa – Producte: estradiol

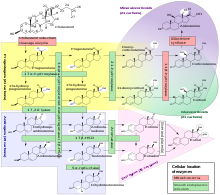
Mecanisme de la reacció química catalitzada per l'enzim aromatasa
Aquest gen codifica un membre de la superfamília dels enzims del citocrom P450. A les proteïnes del citocrom P450 hi ha monooxigenases que catalitzen reaccions de molts components involucrats en el metabolisme de fàrmacs i la síntesi de colesterol, esteroides i altres lípids. Aquesta proteïna es localitza en el reticle endoplasmàtic i catalitza els últims passos de la biosíntesi d'estrògens a partir d'andrògens. Aquests passos inclouen tres metils hidroxilats successius del grup 19 dels andrògens seguit de l'eliminació simultània de grups metil i aromatització de l'anell A. Les mutacions en aquest gen poden augmentar o disminuir l'activitat de l'aromatasa. Els fenotips associats suggereixen que el creixement i diferenciació d'aquest enzim determina les funcions tant de l'estrogen com d'una hormona esteroide sexual. El gen expressa dues variants de la transcripció.
Genòmica
En els humans, el gen CYP19, localitzat en el cromosoma 15q21.1, codifica l'enzim aromatasa. [8] Així, el gen de l'aromatasa ha evolucionat aviat en els cordats i no sembla estar present en els invertebrats no cordats (per exemple, insectes, mol·luscs, equinoderms, esponges, coralls). Tanmateix, els estrògens poden ser sintetitzats en alguns d'aquests organismes, a través d'altres vies desconegudes.
Localització de cèl·lules i teixit
L'enzim es troba en el reticle endoplasmàtic de la cèl·lula i la seva activitat està regulada per promotors específics de teixits que són al mateix temps controlats per les hormones, les citocines, i altres factors. La principal acció de l'enzim transforma l'androstenediona a estrona i la testosterona a estradiol. L'enzim aromatasa es troben en molts teixits, com les gònades, cervell, teixit adipós, la placenta, els vasos sanguinis, pell, ossos, endometri, així com en el teixit de l'endometriosi, fibroides uterins, càncer de mama i càncer d'endometri.
Activitat
Els factors coneguts que augmenten l'activitat de l'aromatasa són l'edat, l'obesitat, la insulina, les gonadotropines i l'alcohol. L'activitat de l'aromatasa és menor per la prolactina, hormona anti-Müller, i el tabaquisme. L'activitat de l'aromatasa sembla augmentar amb els nivells d'estrògens determinats teixits locals que depenen del teixit mamari, càncer d'endometri, endometriosi i fibromes uterins.
Trastorns
- La síndrome d'excés d'aromatasa
- Diversos investigadors han informat d'una síndrome poc freqüent de l'activitat de l'aromatasa en excés. En els nens pot provocar ginecomàstia[9] i en les nenes pubertat precoç i gigantomàstia. En ambdós sexes, es produeix un tancament primerenc de les epífisis.
- La síndrome de deficiència d'aromatasa
- Aquesta síndrome es deu a una mutació del gen CYP19 i s'hereten de manera autosòmica recessiva. L'acumulació d'andrògens durant l'embaràs pot provocar la virilització de la dona en néixer (els homes no es veuen afectats). Les dones, per la seva banda, poden patir amenorrea primària. El tancament de l'epífisi suposa una baixa esperança de vida en individus d'ambdós sexes.
Inhibidors de l'aromatasa
La inhibició de l'enzim porta a hipoestrogenisme profund (nivells baixos d'estrogen). Així, els inhibidors de l'aromatasa s'han convertit en útils en el tractament de pacients amb càncer de mama, lesió detectada per ser receptor d'estrogen.[10][11] Un exemple d'inhibidor de l'aromatasa és letrozol, comercialitzat originalment sota el nom de 'Femara'.
Extractes de certs fongs poden inhibir l'aromatasa.[12]
Regulació i conducta
Nombrosos estudis realitzats amb animals de laboratori han demostrat que els metabòlits estrogènics de testosterona masculinitzen el sistema nerviós i la conducta de rates ratolins.
Es va observar que el tractament neonatal amb una dosi petita d'estradiol, considerat tradicionalmet com a hormona femenina, podria masculinitzar permanentment aquestes conductes. Els resultats sorprenien perquè durant el desenvolupament embrionari, els fetus de rata estaven exposats a nivell alts d'estrògens d'origen matern que travessen la placenta.
Si els estrògens masculinitzen el cervell en desenvolupament, perquè no totes les femelles resulten masculinitzades pels estrògens materns? L'explicació apareix arran de realitzar un examen més minuciós de la síntesi de les hormones esteroidees.
Les molècules de la testosterona i l'estradiol tenen estructures molt afins. De fet, la testosterona és la precursora de l'estradiol en l'ovari. En una única reacció química, denominada aromatització, l'enzim aromatasa transforma la testosterona en estradiol (i certs andrògens en altres estrògens).
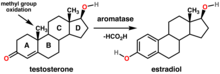
En general els ovaris contenen molta aromatasa, i així mateix també s'observa la presència d'aquest enzim al cervell en nivells considerables.
D'aquestes dades va sorgir la hipòtesi de l'aromatització, que explicava que els andrògens testiculars entren al cervell i allí es converteixen en estrògens, que són els encarregats de masculinitzar el sistema nerviós en desenvolupament de rates i ratolins.
Però, de la mateixa manera, perquè el cervell de les femelles no és masculinitzat pels estrògens materns? Perquè en aquest cas, una proteïna de la sang denominada alfa-fetoproteïna s'uneix als estrògens impedint la seva entrada al cervell, bloquejant els estrògens d'origen perifèric. Així el fetus es desenvolupa femeninament.
Referències
- ↑ 1,0 1,1 1,2 GRCh38: Ensembl release 89: ENSG00000137869 - Ensembl, May 2017
- ↑ 2,0 2,1 2,2 GRCm38: Ensembl release 89: ENSMUSG00000032274 – Ensembl, May 2017
- ↑ «Human PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ «Mouse PubMed Reference:». National Center for Biotechnology Information, U.S. National Library of Medicine.
- ↑ PDB 3EQM; Ghosh D, Griswold J, Erman M, Pangborn W «Structural basis for androgen specificity and oestrogen synthesis in human aromatase». Nature, 457, 7226, January 2009, pàg. 219–23. DOI: 10.1038/nature07614. PMID: 19129847.
- ↑ Simpson ER, Mahendroo MS, Means GD, Kilgore MW, Hinshelwood MM, Graham-Lorence S, Amarneh B, Ito Y, Fisher CR, Michael MD, et al «Aromatase cytochrome P450, the enzyme responsible for estrogen biosynthesis». Endocr Rev., 15, 3, 1994, pàg. 342-55. DOI: 10.1210/edrv-15-3-342. PMID: 8076586.
- ↑ Vaz ADN. «Chapter 1: Cytochrome activation by cytochromes P450: a role for multiple oxidants in the oxidation of substrates». A: Fisher, Michael; Lee, Jae Kyu; Obach, Robert E.. Drug metabolizing enzymes: cytochrome P450 and other enzymes in drug discovery and development. Lausanne, Switzerland: FontisMedia SA, 2003. ISBN 0-8247-4293-1.
- ↑ Toda K, Shizuta Y «Molecular cloning of a cDNA showing alternative splicing of the 5'-untranslated sequence of mRNA for human aromatase P-450». Eur. J. Biochem., 213, 1, abril 1993, pàg. 383–9. DOI: 10.1111/j.1432-1033.1993.tb17772.x. PMID: 8477708.
- ↑ Samuel S. C. Yen, Robert B. Jaffe, Robert L. Barbieri. Endocrinología de la reproducción: fisiología, fisiopatología y manejo clínico (en anglès). Ed. Médica Panamericana, 2001, p.521. ISBN 9500625385.
- ↑ Johnston, JO «Aromatase inhibitors». Crit Rev Biochem Mol Biol., 33, 5, 1998, pàg. 375-405. PMID: 9827706.
- ↑ Attar, E; Bulun, SE «Aromatase inhibitors: the next generation of therapeutics for endometriosis?». Fertil. Steril., 85, 5, 2006, pàg. 1307–18. DOI: 10.1016/j.fertnstert.2005.09.064. PMID: 16647373.
- ↑ Chen S, Oh SR, Phung S, Hur G, Ye JJ, Kwok SL, Shrode GE, Belury M, Adams LS, Williams D «Anti-aromatase activity of phytochemicals in white button mushrooms (Agaricus bisporus)». Cancer Res., 66, 24, December 2006, pàg. 12026–34. DOI: 10.1158/0008-5472.CAN-06-2206. PMID: 17178902.
Bibliografia
- Rosenzweig F. Psicobiologia; Introducción a la neurociencia conductual, cognitiva y clínica. Editorial Ariel S. A.;
- Chen S (2004). "Aromatase and breast cancer". Front. Biosci. 3: d922–33. PMID: 9696881.
- Strobel HW, Thompson CM, Antonovic L (2001). "Cytochromes P450 in brain: function and significance". Curr. Drug Metab. 2 (2): 199–214. doi:10.2174/1389200013338577. PMID: 11469726.
- Simpson ER, Clyne C, Rubin G, et al. (2002). "Aromatase--a brief overview". Annu. Rev. Physiol. 64: 93–127. doi:10.1146/annurev.physiol.64.081601.142703. PMID: 11826265.
- Bulun SE, Yang S, Fang Z, et al. (2002). "Role of aromatase in endometrial disease". J. Steroid Biochem. Mol. Biol. 79 (1-5): 19–25. doi:10.1016/S0960-0760(01)00134-0. PMID: 11850203.
- Balthazart J, Baillien M, Ball GF (2002). "Phosphorylation processes mediate rapid changes of brain aromatase activity". J. Steroid Biochem. Mol. Biol. 79 (1-5): 261–77. doi:10.1016/S0960-0760(01)00143-1. PMID: 11850233.
- Richards JA, Petrel TA, Brueggemeier RW (2002). "Signaling pathways regulating aromatase and cyclooxygenases in normal and malignant breast cells". J. Steroid Biochem. Mol. Biol. 80 (2): 203-12. doi:10.1016/S0960-0760(01)00187-X. PMID: 11897504.
- Balthazart J, Baillien M, Ball GF (2002). "Interactions between aromatase (estrogen synthase) and dopamine in the control of male sexual behavior in quail". Comp. Biochem. Physiol. B, Biochem. Mol. Biol. 132 (1): 37–55. doi:10.1016/S1096-4959(01)00531-0. PMID: 11997208.
- Meinhardt U, Mullis PE (2002). "The aromatase cytochrome P-450 and its clinical impact". Horm. Res. 57 (5-6): 145–52. doi:10.1159/000058374. PMID: 12053085.
- Carreau S, Bourguiba S, Lambard S, et al. (2003). "Reproductive system: aromatase and estrogens". Mol. Cell. Endocrinol. 193 (1-2): 137–43. doi:10.1016/S0303-7207(02)00107-7. PMID: 12161013.
- Meinhardt U, Mullis PE (2003). "The essential role of the aromatase/p450arom". Semin. Reprod. Med. 20 (3): 277–84. doi:10.1055/s-2002-35374. PMID: 12428207.
- Carreau S, Bourguiba S, Lambard S, Galeraud-Denis I (2003). "[Testicular aromatase]". J. Soc. Biol. 196 (3): 241–4. PMID: 12462076.
- Carani C, Fabbi M, Zirilli L, Sgarbi I (2003). "[Estrogen resistance and aromatase deficiency in humans]". J. Soc. Biol. 196 (3): 245–8. PMID: 12462077.
- Kragie L (2003). "Aromatase in primate pregnancy: a review". Endocr. Res. 28 (3): 121–8. doi:10.1081/ERC-120015041. PMID: 12489562.
- Simpson ER (2004). "Biology of aromatase in the mammary gland". Journal of mammary gland biology and neoplasia 5 (3): 251–8. doi:10.1023/A:1009590626450. PMID: 14973387.
- Bulun SE, Takayama K, Suzuki T, et al. (2004). "Organization of the human aromatase p450 (CYP19) gene". Semin. Reprod. Med. 22 (1): 5–9. doi:10.1055/s-2004-823022. PMID: 15083376.
- Simpson ER (2004). "Aromatase: biologic relevance of tissue-specific expression". Semin. Reprod. Med. 22 (1): 11–23. doi:10.1055/s-2004-823023. PMID: 15083377.
- Bulun SE, Fang Z, Imir G, et al. (2004). "Aromatase and endometriosis". Semin. Reprod. Med. 22 (1): 45–50. doi:10.1055/s-2004-823026. PMID: 15083380.
- Shozu M, Murakami K, Inoue M (2004). "Aromatase and leiomyoma of the uterus". Semin. Reprod. Med. 22 (1): 51–60. doi:10.1055/s-2004-823027. PMID: 15083381.
- Chen S, Ye J, Kijima I, et al. (2005). "Positive and negative transcriptional regulation of aromatase expression in human breast cancer tissue". J. Steroid Biochem. Mol. Biol. 95 (1-5): 17–23. doi:10.1016/j.jsbmb.2005.04.002. PMID: 15955695.
- Lambard S, Silandre D, Delalande C, et al. (2005). "Aromatase in testis: expression and role in male reproduction". J. Steroid Biochem. Mol. Biol. 95 (1-5): 63–9. doi:10.1016/j.jsbmb.2005.04.020. PMID: 16019206.
- Bulun SE, Imir G, Utsunomiya H, et al. (2005). "Aromatase in endometriosis and uterine leiomyomata". J. Steroid Biochem. Mol. Biol. 95 (1-5): 57–62. doi:10.1016/j.jsbmb.2005.04.012. PMID: 16024248.
- Lambard S, Carreau S (2005). "Aromatase and oestrogens in human male germ cells". Int. J. Androl. 28 (5): 254–9. doi:10.1111/j.1365-2605.2005.00546.x. PMID: 16128984.
- Ellem SJ, Risbridger GP (2006). "Aromatase and prostate cancer". Minerva Endocrinol. 31 (1): 1–12. PMID: 16498360.
- Brueggemeier RW, Díaz-Cruz ES (2006). "Relationship between aromatase and cyclooxygenases in breast cancer: potential for new therapeutic approaches". Minerva Endocrinol. 31 (1): 13–26. PMID: 16498361.
- Jongen VH, Hollema H, Van Der Zee AG, Heineman MJ (2006). "Aromatase in the context of breast and endometrial cancer. A review". Minerva Endocrinol. 31 (1): 47–60. PMID: 16498363.
- Hiltunen M, Iivonen S, Soininen H (2006). "Aromatase enzyme and Alzheimer's disease"
Enllaços externs
- "U.S. study of gay sheep may shed light on sexuality", Viquinotícies en anglès, 15 agost 2005.