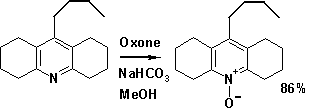Hydrogénopersulfate de potassium
| Hydrogénopersulfate de potassium | |||
 | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | hydrogénopersulfate de potassium | ||
| Synonymes | peroxymonosulfate de potassium | ||
| No CAS | 10361-76-9 37222-66-5 (sel triple - voir le texte) | ||
| No ECHA | 100.030.158 | ||
| PubChem | 23712892 | ||
| SMILES | [O-]S(=O)(=O)O=O.[K+] PubChem, vue 3D | ||
| InChI | InChI : vue 3D InChI=1/K.HO5S/c;1-5-6(2,3)4/h;(H,2,3,4)/q+1;/p-1 | ||
| Propriétés chimiques | |||
| Formule | HKO5SKHSO5 | ||
| Masse molaire[1] | 152,168 ± 0,007 g/mol H 0,66 %, K 25,69 %, O 52,57 %, S 21,07 %, | ||
| Précautions | |||
| Directive 67/548/EEC[2] | |||
 C  O Symboles : C : Corrosif O : Comburant Phrases R : R8 : Favorise l’inflammation des matières combustibles. R34 : Provoque des brûlures. R37 : Irritant pour les voies respiratoires. Phrases S : S17 : Tenir à l’écart des matières combustibles. S36/37/39 : Porter un vêtement de protection approprié, des gants et un appareil de protection des yeux/du visage. | |||
| Transport | |||
Numéro ONU : 3260 : SOLIDE INORGANIQUE CORROSIF, ACIDE, N.S.A. Classe : 8 Étiquette :  8 : Matières corrosives Emballage : Groupe d'emballage II : matières moyennement dangereuses ; | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
modifier  | |||
L'hydrogénopersulfate de potassium ou peroxymonosulfate de potassium [aussi connu sous l'abréviation MPS (pour monopersulfate) et les noms de marque Caroat et Oxone] est le sel de potassium de l'acide persulfurique. Il est largement utilisé comme agent oxydant en chimie organique[3].
Ce sel est commercialisé par quatre compagnies : Arch Pool Chemicals (une filiale de Lonza Pharma Group), Evonik (auparavant Degussa) sous le nom de marque Caroat, DuPont sous le nom de marque Oxone (qui maintenant est devenu un mot commun dans le vocabulaire de la chimie) et Hangzhou Focus Chemical Co., Ltd. C'est le composant actif du sel triple du monopersulfate de potassium, de formule 2KHSO5•KHSO4•K2SO4[4]. Le potentiel standard (E0) de KHSO5 vaut 1,85 V[4] pour la demi-réaction qui génère l'ion hydrogénosulfate :
- HSO5− + 2 H+ + 2 e− → HSO4− + H2O E0 = 1,85 V
Réactions
L'oxone est un oxydant polyvalent[3]. Il oxyde les aldéhydes en acides carboxyliques, en présence de solvants alcooliques, les esters peuvent être obtenus. Les alcènes internes peuvent être clivés pour donner deux acides carboxyliques tandis que les alcènes terminaux sont époxydés. Les thioéthers donnent des sulfones, les amines tertiaires des amines oxydes et les phosphines des oxydes de phosphine[5].
Une illustration du pouvoir oxydant de ce sel est la conversion d'un dérivé de l'acridine en l'acridine-N-oxyde correspondant[6] :
Il oxyde aussi un thioéther en sulfone avec deux équivalents[7], et avec un seul équivalent, la réaction s'arrête au stade sulfoxyde car la réaction qui convertit le sulfure en sulfoxyde est beaucoup plus rapide que la réaction qui convertit le sulfoxyde en sulfone. Il est ainsi possible d'arrêter facilement la réaction au stade désiré :
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Potassium peroxymonosulfate » (voir la liste des auteurs).
- ↑ Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ↑ http://www.tcieurope.eu/fr/catalog/O0310.html
- ↑ a et b « Oxone, Potassium peroxomonosulfate », sur organic-chemistry.org (consulté le ).
- ↑ a et b (en) « DuPont Oxone Monopersulfate Compound - General technical attributes » [PDF], (consulté le )
- ↑ (en) Benjamin R. Travis, Meenakshi Sivakumar, G. Olatunji Hollist, and Babak Borhan, « Facile Oxidation of Aldehydes to Acids and Esters with Oxone », Organic Letters, vol. 5, no 7, , p. 1031 (PMID 12659566, DOI 10.1021/ol0340078)
- ↑ Thomas W. Bell, Young-Moon Cho, Albert Firestone, Karin Healy, Jia Liu, Richard Ludwig, and Scott D. Rothenberger, 9-n-Butyl-1,2,3,4,5,6,7,8-Octahydroacridin-4-ol, Org. Synth., coll. « vol. 8 », , p. 87
- ↑ James R. McCarthy, Donald P. Matthews, and John P. Paolini, Reaction of Sulfoxides with Diethylaminosulfur Trifluoride, Org. Synth., coll. « vol. 9 », , p. 446
Voir aussi
Article connexe
Liens externes
- Utilisations
- (en) DuPont Oxone Monopersulfate Compound Applications
- (en) « Potassium Monopersulfate »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) – Article on precious metal extraction from distributor Green
- Données
- (en) DuPont Oxone Monopersulfate Compound Technical Information
v · m | |
|---|---|
|
 Portail de la chimie
Portail de la chimie