Meldrum's zuur
| Meldrum's zuur | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
 | ||||
Structuurformule van Meldrum's zuur | ||||
| Algemeen | ||||
| Molecuulformule | ||||
| Andere namen | Isopropylideenmalonaat | |||
| Molmassa | 144,126 g/mol | |||
| SMILES | Smiles[1] | |||
| InChI | InChi[2] | |||
| CAS-nummer | 2033-24-1 | |||
| PubChem | 16249 | |||
| Wikidata | Q421283 | |||
| Beschrijving | kleurloze, vaste stof | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | kleurloos | |||
| Smeltpunt | (ontleed)[3] 94-95 °C | |||
| Slecht oplosbaar in | water | |||
| Evenwichtsconstante(n) | pKz = 4.97 | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Meldrum's zuur, of 2,2-dimethyl-1,3-dioxaan-4,6-dion, is een organische verbinding met de formule . Het centrale deel van het molecuul bestaat uit een hetroclische zesring met 4 koolstof- en twee zuurstof-atomen.
De verbinding is een kleurloze vaste stof, die slechts weinig in water oplosbaar is. Bij verwarmen ontleedt de stof, waarbij aceton en koolstofdioxide vrijkomen.[4][5]
Eigenschappen
Zuursterkte
De verbinding staat makkelijk een proton af uit de methyleenbrug tussen de twee dubbel gebonden zuurstof-atomen (koolstof-atoom 5). Dit kan in eerste instantie beschreven worden als het vormen van een dubbele band tussen C5 en één van de koolstof-atomen met een dubbel gebonden zuurstof; de negatieve lading verschuikt naar het zuurstof-atoom. Het gevormde anion, wordt door resonantie gestabiliseerd en elk zuurstof-atoom draagt een formele lading van −1/2.

De pKz van de verbinding is 4,97. De verbinding gedraagt zich als een éénwaardig zuur, hoewel het geen carbonzuurgroep bevat. Hiermee gedraagt Meldrum's zuur zich op een vergelijkbare manier als dimedon en barbituurzuur. De waarde van pKz geeft aan dat dit zuur slechts weinig zwakker is dan azijnzuur. In een waterige oplossing betekent dit echter wel dat het grootste deel van de moleculen als neutraal molecuul aanwezig is.[4]
De ongebruikelijk grote zuursterkte, 8 grootte-ordes zuurder dan het verwante dimethylmalonaat, maakte deze stof tot een onregelmatigheid in de theorie. In 2004 stelde Ohwada etal vast dat in de evenwichtsconformatie de σCH-orbitaal en de π*CO voldeden aan de geometrische voorwaarden voor interactie. De CH-binding wordt hierdoor verzwakt zodat het proton relatief makkelijk wordt afgestaan. In Meldrum's zuur wordt deze conformatie afgedwongen door de ring, in dimethylmalonaat ontbreekt de ring, dus ook de geforceerde geometrie.[6]
Syntese
Oorspronkelijke synthese
De verbinding werd voor het eerst bereid door de Schotse scheikundige Andrew Meldrum (1876-1934) in de directe reactie tussen aceton en malonzuur in azijnzuuranhydride en zwavelzuur.[5]

Alternatieve syntheses
Als alternatief voor de oorspronkelijke synthese kan in plaats van aceton en azijnzuuranhydride gebruik gemaakt worden van isopropenylacetaat (een enol afgeleid van aceton), en een katalytische hoeveelheid zwavelzuur.
Een derde benadering gaat uit van koolstofsuboxide, en aceton in aanwezigheid van oxaalzuur.[4]
Toepassingen
Net zoals malonzuur, zijn esters en andere 1,3-diketonen kan Meldrum's zuur gebruikt worden als nucleofiel in een groot aantal reacties.
Alkylering en acylering
Het gemaak waarmee een waterstof-atoom wordt afgestaan vanaf C5 (tussen de twee dubbelgebonden zuurstofatomen) maakt substitutie op die positie eenvoudig via alkylering en acylering. Zo leidt deprotoneren, gevolgd door reactie met een alkylhalogenide, tot het koppelen van de alkylgroep op die plek:
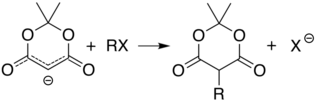
De analoge reactie met een acylchloride, , koppelt de acylgroep aan C5:
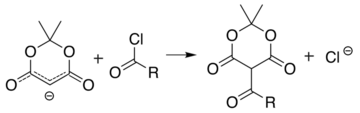
Deze twee reacties maken Meldrum's zuur tot een goede uitgangsstof voor een grote verscheidenheid aan organische structeren die bovendien over een groot aantal functionele groepen kunnen beschikken. De gealkyleerde producten kunnen omgezet worden in diverse amide's en esters. De geacyleerde verbindingen maken onder verwarming met alcoholen in andere esters toegankelijk of ondergaan decarboxylering op een vergelijkbare manier als in de malonzuurestersynthese.
De hoge reactiviteit van de cyclische di-ester maken zelfs reacties met sterisch gehinderde alcoholen als tertbutanol mogelijk.[7] Op basis van deze reactiviteit zijn verschillende nieuwe syntheseroutes ontwikkeld.[8][9][10][11]
Ketoesters uit de reactie van alkanolen met derivaten van Meldrum's zuur zijn goed bruikbaar in de Knorr pyrrool synthese.
Synthese van ketenen
Bij temperaturen boven 200 °C[12] ondergaat Meldrum's zuur een pericyclische reactie waarbij, naast aceton en koolstofdioxide een hoog reactief keteen ontstaat:[13]

De ontstane ketenen kunnen met behulp van flash vacuum pyrolyse (FVP) geïsoleerd worden. Ketenen zijn zeer nucleofiele deeltjes die makkelijk dimeriseren tot diketenen en additiereacties ondergaan met een groot aantal verschillende reagentia waarbij nieuwe C-C-bindingen worden gevormd, ringen ontstaan of amides (links), esters (midden) en zuren (rechts):
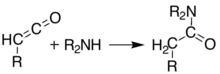 | 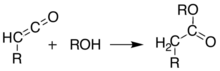 |  |
Als alternatief kan de pyrolyse uitgevoerd worden als "one pot reactie" in een oplossing, het keteen wordt niet geïsoleerd.
De grote verscheidenheid aan mogelijke reactieproducten maakt Meldrum's zuur een zeer bruikbaar reagens in het synthetisch organisch arsenaal.[14][15][16]
Geschiedenis

De stof is vernoemd naar Andrew Norman Meldrum die de synthese in 1908 beschreef.[5] Hij dacht echter het β-lacton van β-hydroxyisopropylmalonzuur gemaakt te hebben. De correcte structuur als het bislacton van 1,3-dioxaan werd in 1948 beschreven.[17]
- Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Meldrum's acid op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar.
Algemene informatie over deze stof
- Gerencsér, János, Dormán, György, Darvas, Ferenc (2006). Meldrum's Acid in Multicomponent Reactions: Applications to Combinatorial and Diversity-Oriented Synthesis. QSAR & Combinatorial Science 25 (5–6): 439–448. DOI: 10.1002/qsar.200540212.
- Ivanov, Andrey S. (2008). Meldrum's acid and related compounds in the synthesis of natural products and analogs. Chem. Soc. Rev. 37 (4): 789–811. PMID 18362984. DOI: 10.1039/B716020H.
- Kidd, Hamish (October 29, 2008). Meldrum's Acid. Chemistry World: 35–36.
- Verwijzingen in de tekst
- ↑ Smiles: O=C1OC(OC(=O)C1)(C)C
- ↑ InChi: 1/C6H8O4/c1-6(2)9-4(7)3-5(8)10-6/h3H2,1-2H3
- ↑ "Meldrum's Acid". The Merck Index. 14th. Vol. edition. Merck Research Laboratories. 2006. p. 1005. ISBN 978-0-911910-00-1.}
- ↑ a b c McNab, Hamish (1978). Meldrum's acid. Chemical Society Reviews 7 (3): 345–358. DOI: 10.1039/CS9780700345.
- ↑ a b c Norman Meldrum, Andrew (1908). A β-lactonic acid from acetone and malonic acid. Journal of the Chemical Society, Transactions 93: 598–601. DOI: 10.1039/CT9089300598.
- ↑ Nakamura, Satoshi, Hirao, Hajime, Ohwada, Tomohiko (2004). Rationale for the Acidity of Meldrum's Acid. Consistent Relation of C−H Acidities to the Properties of Localized Reactive Orbital. J. Org. Chem. 69 (13): 4309–4316. PMID 15202884. DOI: 10.1021/jo049456f.
- ↑ Oikawa, Yuji, Sugano, Kiyoshi, Yonemitsu, Osamu (1978). Meldrum's acid in organic synthesis. 2. A general and versatile synthesis of β-keto esters. J. Org. Chem. 43 (10): 2087–2088. DOI: 10.1021/jo00404a066.
- ↑ Ghosh, Santanu, Purkait, Anisha, Jana, Chandan K. (2020). Environmentally benign decarboxylative N -, O -, and S -acetylations and acylations. Green Chemistry 22 (24): 8721–8727. DOI: 10.1039/D0GC03731A.
- ↑ Li, Jiang-Sheng, Da, Yu-Dong, Chen, Guo-Qin, Yang, Qian, Li, Zhi-Wei (13 February 2017). Solvent-, and Catalyst-free Acylation of Anilines with Meldrum's Acids: A Neat Access to Anilides. ChemistrySelect 2 (5): 1770–1773. DOI: 10.1002/slct.201601965.
- ↑ Davis, Garrett J., Sofka, Holly A., Jewett, John C. (3 april 2020). Highly Stable Meldrum's Acid Derivatives for Irreversible Aqueous Covalent Modification of Amines. Organic Letters 22 (7): 2626–2629. PMID 32191483. PMC 7679203. DOI: 10.1021/acs.orglett.0c00597.
- ↑ Heard, David M., Lennox, Alastair J. J. (7 May 2021). Dichloromeldrum's Acid (DiCMA): A Practical and Green Amine Dichloroacetylation Reagent. Organic Letters 23 (9): 3368–3372. PMID 33844547. DOI: 10.1021/acs.orglett.1c00850.
- ↑ Gaber, Abd El-Aal M., McNab, Hamish (2001). Synthetic Applications of the Pyrolysis of Meldrum's Acid Derivatives. Synthesis 2001 (14): 2059–2074. DOI: 10.1055/s-2001-18057.
- ↑ Dumas, Aaron M., Fillion, Eric (2009). Meldrum's Acids and 5-Alkylidene Meldrum's Acids in Catalytic Carbon–Carbon Bond-Forming Processes. Acc. Chem. Res. 43 (3): 440–454. PMID 20000793. DOI: 10.1021/ar900229z.
- ↑ Oikawa, Yuji, Hirasawa, Hitoshi, Yonemitsu, Osamu (1978). Meldrum's acid in organic synthesis. 1. A convenient one-pot synthesis of ethyl indolepropionates. Tetrahedron Letters 19 (20): 1759–1762. DOI: 10.1016/0040-4039(78)80037-9.
- ↑ Lipson, Victoria V., Gorobets, Nikolay Yu. (2009). One hundred years of Meldrum's acid: Advances in the synthesis of pyridine and pyrimidine derivatives. Mol. Divers. 13 (4): 399–419. PMID 19381852. DOI: 10.1007/s11030-009-9136-x.
- ↑ Bonifácio, Vasco D. B. (2004). Meldrum's Acid. Synlett 2004 (9): 1649–1650. DOI: 10.1055/s-2004-829539.
- ↑ Davidson, David, Bernhard, Sidney A. (1948). The Structure of Meldrum's Supposed β-Lactonic Acid. Journal of the American Chemical Society 70 (10): 3426–3428. PMID 18891879. DOI: 10.1021/ja01190a060.

















