Molibdato


Em química, um molibdato é um composto que contém um oxoânion com molibdênio no seu mais elevado estado de oxidação de +6. O molibdénio pode formar uma grande variedade de tais oxianiões que podem ser estruturas discretas ou estruturas [polímero|poliméricas]] estendidas, embora este último tipo seja apenas encontrado no estado sólido. Os oxianiões maiores são membros de um grupo de compostos chamados polioxometalatos, e porque contêm um só tipo de átomo metálico são muitas vezes chamados isopolimetalatos. Os oxiânions de molibdénio discretos variam em tamanho desde o mais simples MoO42−, encontrado em sais como o molibdato de potássio, até às grandes estruturas encontradas nos azuis de molibdénio que contêm até 154 átomos de Mo. O comportamento do molibdénio é diferente do dos outros elementos do grupo 6. O crómio forma apenas os iões cromato, CrO42−, Cr2O72−, Cr3O102− e Cr4O132− todos baseados no crómio tetraédrico. O tungstênio é semelhante ao molibdénio e forma muitos tungstatos contendo tungsténio com coordenação 6.[1]
Exemplos de oxianiões de molibdato
- MoO42− discreto, em Na2MoO4 e no mineral powellite, CaMoO4;
- Mo2O72− discreto no sal de tetrabutilamónio e Mo2O72− polimérico no sal de amónio;[2]
- Mo3O102− polimérico no sal de etilenodiamina;[3]
- Mo4O132− polimérico no sal de potássio;[4]
- Mo5O162− polimérico no sal de anilínio (C6H5NH3)+;[5]
- Mo6O192−(hexamolibdato) discreto no sal de tetrametilamónio;[6]
- Mo7O246− discreto em molibdato de amónio, (NH4)6Mo7O24.4H2O;[7]
- Mo8O264− no sal de trimetilamónio.[8]
A designação dos molibdatos segue geralmente a convenção de um prefixo para indicar o número de iões de Mo presentes. Por exemplo, dimolibdato para dois átomos de molibdénio; trimolibdato para três átomos de molibdénio, etc.. Por vezes o estado de oxidação é adicionado como sufixo, como em pentamolibdato (VI). O ião heptamolibdato, Mo7O24 6−, é frequentemente chamado "paramolibdato".
Estrutura dos aniões de molibdato
Os aniões menores, MoO42− e Mo2O72− contêm apenas molibdénio com coordenação 4, MoO42− é tetraédrico e Mo2O72− pode ser visto como dois tetraedros partilhando um vértice, ou seja, com um único átomo de O de ligação.[8] Nos aniões maiores, o molibdénio geralmente, mas não só, apresenta coordenação 6 com partilha dos vértices dos octaedros de MoO6. Os octaedros são distorcidos, e os comprimentos das ligações M-O típicos são:
- em M-O terminais aproximadamente 1,7 Å
- em unidades M-O-M de ligação aproximadamente 1,9 Å
O anião Mo8O264− contém molibdénio octaédrico e tetraédrico e pode ser isolado sob duas formas isoméricas, alfa e beta.[1]
A imagem do hexamolibdato abaixo mostra os poliedros de coordenação. A imagem do heptamolibdato mostra o aspecto mais compacto dos átomos de oxigénio na estrutura. O ião óxido tem um raio iónico igual a 1,40 Å, o molibdénio (VI) é muito menor, 0,59 Å.[8] Existem fortes semelhanças entre as estruturas dos molibdatos e as dos óxidos de molibdénio, (MoO3, MoO2 óxidos de "cisalhamento cristalográfico", Mo9O26 e Mo10O29) cujas estruturas todas contêm iões óxido bastante juntos.[9]
-
 hexamolibdato
hexamolibdato -
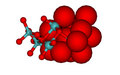 heptamolibdato
heptamolibdato
Equilíbrios em solução aquosa
Quando o trióxido de molibdênio (MoO3) é dissolvido numa solução alcalina, é produzido o anião simples MoO42−. À medida que o pH da solução é reduzido, a primeira espécie a formar-se é o heptamolibdato em vez de qualquer um dos aniões menores:
- 7 MoO42− + 8H+
 Mo7O246− + 4H2O [1]
Mo7O246− + 4H2O [1]
À medida que o pH é reduzido forma-se octamolibdato e estão presentes outros aniões com 8 e talvez 16-18 átomos de Mo:[8]
- Mo7O246− + 3H+
 Mo8O264− + 2H2O [1]
Mo8O264− + 2H2O [1]
Uma diminuição do pH ainda maior conduz à formação de aniões provavelmente com 16 a 18 átomos de molibdénio. Contudo a manipulação cuidadosa do pH e da temperatura em conjunto com tempos de precipitação muito longos podem fazer precipitar compostos com iões que não parecem estar em solução.[8]
Usos industriais
O molibdato tem sido usado no tratamento de água industrial como inibidor de corrosão. Pensava-se inicialmente que seria um bom substituto para o cromato, quando este foi banido devido à sua toxidade. Contudo, o molibdato tem uma ação anticorrosiva moderada,,[10] e é usado sobretudo em circuitos de arrefecimento fechados de alta temperatura.[11]
O molibdato (geralmente na forma de molibdato de potássio) é também usado em ensaios colorimétricos para determinação da concentração de sílica em solução, a que se dá o nome de método do azul de molibdénio.[12] Adicionalmente, é usado na determinação colorimétrica da quantidade de fosfato em associação com o corante verde malaquita.
- Este artigo foi inicialmente traduzido, total ou parcialmente, do artigo da Wikipédia em inglês cujo título é «Molybdate», especificamente desta versão.
Referências
- ↑ a b c d Cotton, F. Albert; Wilkinson, Geoffrey; Murillo, Carlos A.; Bochmann, Manfred (1999), Advanced Inorganic Chemistry, ISBN 0-471-19957-5 6th ed. , New York: Wiley-Interscience !CS1 manut: Nomes múltiplos: lista de autores (link)
- ↑ V. W. Day; M. F. Fredrich; W. G. Klemperer; W. Shum (1977). «Synthesis and characterization of the dimolybdate ion, Mo2O72−». Journal of the American Chemical Society. 99 (18): 6146. doi:10.1021/ja00460a074
- ↑ Guillou N.; Ferey G. (1997). «Hydrothermal Synthesis and Crystal Structure of Anhydrous Ethylenediamine Trimolybdate (C2H10N2)[Mo3O10]». Journal of Solid State Chemistry. 132 (1): 224–227(4). doi:10.1006/jssc.1997.7502
- ↑ B. M. Gatehouse; P. Leverett (1971). «Crystal structure of potassium tetramolybdate, K2Mo4O13, and its relationship to the structures of other univalent metal polymolybdates». J. Chem. Soc. A: 2107–2112. doi:10.1039/J19710002107
- ↑ W. Lasocha; H. Schenk (1997). «Crystal Structure of Anilinium Pentamolybdate from Powder Diffraction Data. The Solution of the Crystal Structure by Direct Methods Package POWSIM». J. Appl. Cryst. 30 (6): 909–913. doi:10.1107/S0021889897003105
- ↑ S. Ghammami (2003). «The crystal and molecular structure of bis(tetramethylammonium) hexamolybdate(VI)». Cryst. Res. Technol. 38 (913). 913 páginas. doi:10.1002/crat.200310112
- ↑ Howard T. Evans jr.; Bryan M. Gatehouse; Peter Leverett (1975). «Crystal structure of the heptamolybdate(VI)(paramolybdate) ion, [Mo7O24]6−, in the ammonium and potassium tetrahydrate salts». J. Chem. Soc., Dalton Trans. (6): 505–514. doi:10.1039/DT9750000505
- ↑ a b c d e Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements 2nd ed. Oxford: Butterworth-Heinemann. ISBN 0080379419 !CS1 manut: Nomes múltiplos: lista de autores (link)
- ↑ Oxides: solid state chemistry W.H. McCarroll Encyclopedia of Inorganic Chemistry Ed. R. Bruce King, John Wiley and sons (1994)ISBN 0-471-93620-0
- ↑ «Open Recirculating Cooling Systems - GE Water». gewater.com
- ↑ «Closed Recirculating Cooling Systems - GE Water». gewater.com
- ↑ «ASTM D7126 - 15 Standard Test Method for On-Line Colorimetric Measurement of Silica». astm.org












